Im Zusammenhang mit in Wasser gelösten Stoffen ist immer wieder von Ionen, Kationen und Anionen die Rede.
Was ist das eigentlich?
Um das verständlich zu erklären, folgt ein kleiner Ausflug in die Chemie, ohne großartig wissenschaftlich werden zu wollen.
Atome
Ein Atom ist der kleinste Baustein in der Chemie. Es gibt über 100 unterschiedliche Atome, die chemischen Elemente wie zum Beispiel Wasserstoff (H) und Sauerstoff (O).
Neutronen, Protonen und Elektronen
Ein Atom besteht aus einem Kern und einer Hülle.
Der Atomkern besteht aus Neutronen (keine elektrische Ladung) und Protonen (positive elektrische Ladung).
In der Atomhülle kreisen Elektronen (negative elektrische Ladung) um den Atomkern.
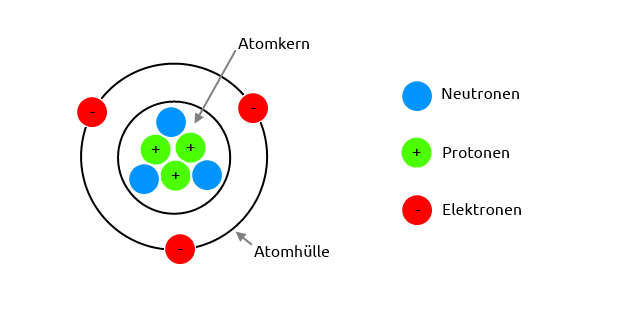
Ein Atom ist elektrisch neutral, das heißt, die Anzahl der Elektronen (-) in der Hülle entspricht der Anzahl der Protonen (+) im Kern.
Moleküle
Moleküle sind Verbindungen von Atomen.
Wasser zum Beispiel ist die Verbindung von
- zwei Wasserstoffatomen, chemische Abkürzung H und
- einem Sauerstoffatom, chemische Abkürzung O.
Die chemische Formel eines Wassermoleküls lautet H2O.
Ionen
Durch chemische und physikalische Prozesse können der Hülle eines Atoms Elektronen hinzugefügt oder entnommen werden.
Atome und Moleküle, bei denen die Anzahl der Protonen nicht mit der Anzahl der Elektronen übereinstimmt, nennt man Ionen.
Positiv und negativ geladene Ionen
Abhängig davon, ob ein Ion mehr Elektronen als Protonen hat oder umgekehrt, erhält es eine positive oder negative elektrische Ladung.
Ionen werden abhängig von ihrer Ladung unterschiedlich bezeichnet.
Anionen
Hat ein Ion mehr Elektronen (-) als Protonen (+), besteht ein Elektronenüberschuss.
Es ist negativ geladen. Negativ geladene Ionen nennt man Anionen.
Einige in Wasser vorkommende Anionen werden im Artikel Anionen im Trinkwasser erklärt.
Kationen
Daraus folgt natürlich, dass ein Ion mit weniger Elektronen (-) als Protonen (+) einen Elektronenmangel hat.
Es ist positiv geladen. Positiv geladene Ionen nennt man Kationen.
Einige in Wasser vorkommende Kationen werden im Artikel Kationen im Trinkwasser erklärt.
 Das nasse Element Ein Blog über Wasser
Das nasse Element Ein Blog über Wasser 

